佐藤裕介 研究内容
ユビキチンシグナルの構造解析
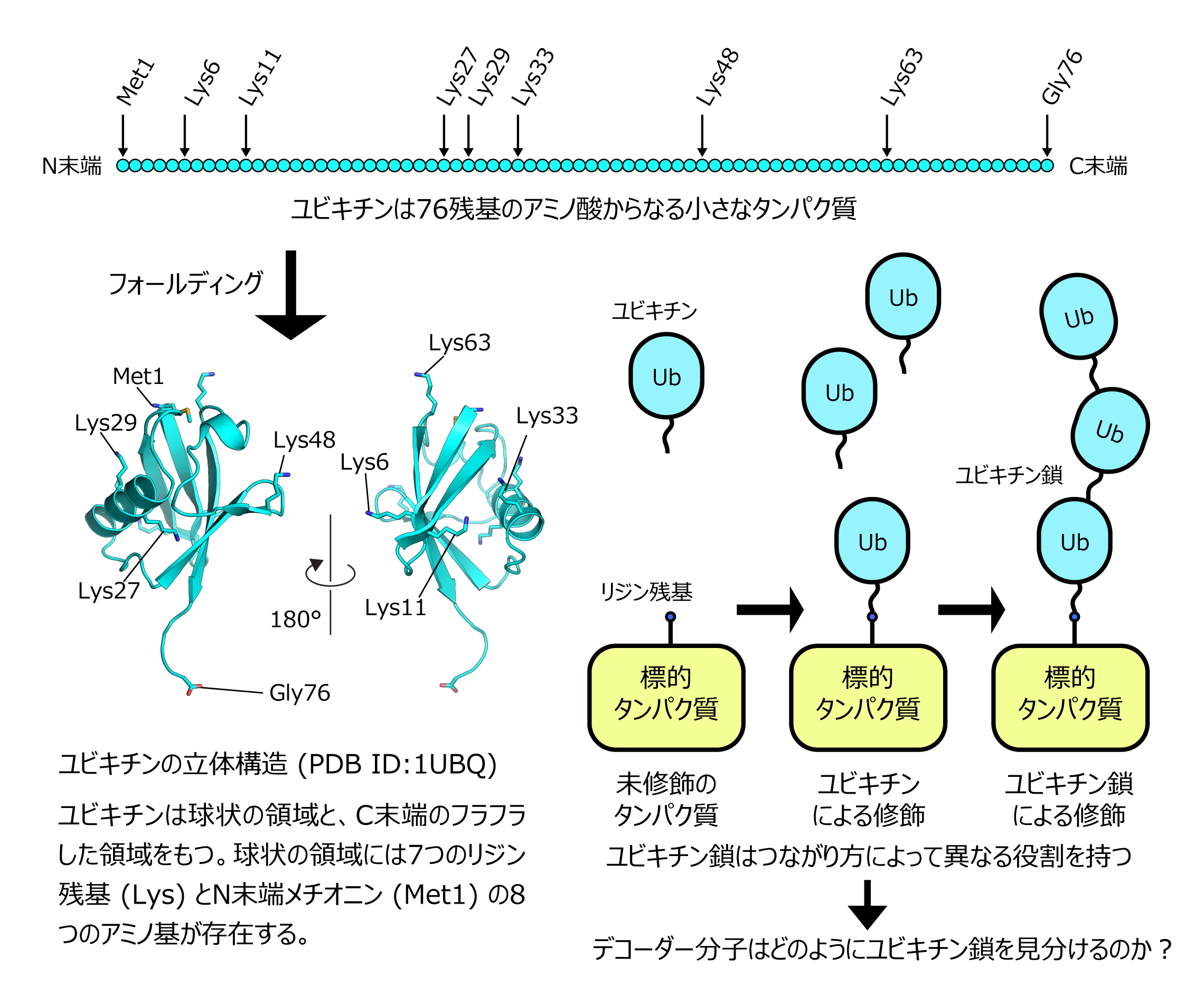
ユビキチン(Ub)は76アミノ酸残基からなる小さなタンパク質で、多様な標的タンパク質に存在するリジン残基のアミノ基と酵素反応によって結合して、そのタンパク質の役割を様々に制御する役割を持ちます。また、ユビキチン自身もリジン残基を7つ(Lys6, 11, 27, 29, 33, 48, 63)持っている他、N末端のメチオニン(Met1)のアミノ基が存在するため、ユビキチンはこれらのアミノ基を使って次々と結合していくことができます。このようにしてできたユビキチンが連続したものを、ユビキチン鎖とよびます。ユビキチンのどの残基でつながるかによって、構造の異なるユビキチン鎖が形成されるので、細胞内には8種類のユビキチン鎖が作られます(実際には途中でつながり方が変わったり、枝分かれがあったりする他、ユビキチンがリン酸化やアセチル化を受ける事もあるのでもっと種類が増えます)。細胞内で、この多様なユビキチン鎖は特異的に結合するエフェクター(デコーダー分子)によって読み解かれ、ユビキチン鎖の種類ごとに異なる細胞機能を制御します。ユビキチン修飾はタンパク質分解やDNA修復、免疫・炎症応答など重要な細胞機能に密接に関わっているため、その破綻は細胞の癌化など、様々な疾病の原因となります。 佐藤講師のグループでは、このユビキチン修飾系に着目し、立体構造決定により多様なユビキチン鎖がどのように細胞内でデコーダー分子に認識され、機能しているのかを解明します。
現在、様々なデコーダー分子の立体構造解析に取り組んでいる他、他大学との共同研究で、新規に開発された阻害剤とユビキチン関連酵素との複合体の構造解析にも取り組んでいます
以下では最近取り組んでいる具体的な研究テーマを紹介します。
1. デコーダーが多様なユビキチン鎖を見分ける仕組みの解明
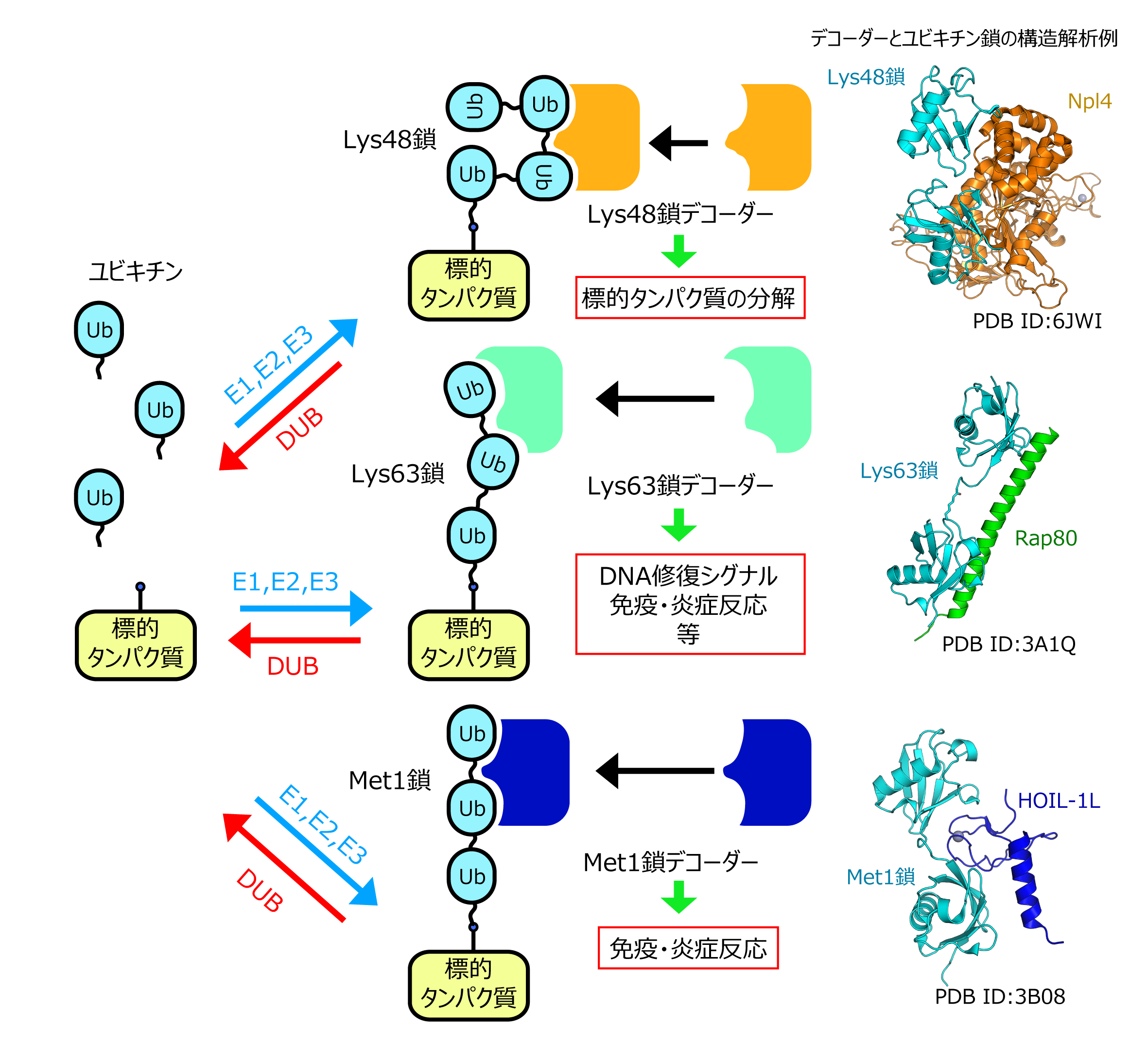 ユビキチン鎖は、細胞内でE1、E2、E3という三種類の酵素が順番に働くことで伸長し、逆に脱ユビキチン化酵素(DUB)によって切断されます。E2やE3の種類によって作られるユビキチン鎖のつながり方は異なり、このつながり方の違いで異なる役割を持ちます。一番よく知られているのはLys48でつながったユビキチン鎖(Lys48鎖)で、異常なタンパク質や不要なタンパク質が、プロテアソームという巨大なタンパク質分解酵素複合体によって分解を受ける際の分解の目印として働きます。一方、Lys63でつながったユビキチン鎖(Lys63鎖)は、DNA修復や免疫・炎症反応のシグナルとして機能するなど、ユビキチン鎖は種類ごとに細胞内で異なる機能を有していると考えられています。このようにユビキチン鎖ごとに機能が異なるのは、デコーダー分子がユビキチン鎖の種類を見分けているためです。私たちはデコーダー分子がどのようにユビキチン鎖を見分けているのかを原子レベルで理解することを目的に、デコーダー分子とユビキチン鎖との複合体の構造解析に取り組んでいます。
ユビキチン鎖は、細胞内でE1、E2、E3という三種類の酵素が順番に働くことで伸長し、逆に脱ユビキチン化酵素(DUB)によって切断されます。E2やE3の種類によって作られるユビキチン鎖のつながり方は異なり、このつながり方の違いで異なる役割を持ちます。一番よく知られているのはLys48でつながったユビキチン鎖(Lys48鎖)で、異常なタンパク質や不要なタンパク質が、プロテアソームという巨大なタンパク質分解酵素複合体によって分解を受ける際の分解の目印として働きます。一方、Lys63でつながったユビキチン鎖(Lys63鎖)は、DNA修復や免疫・炎症反応のシグナルとして機能するなど、ユビキチン鎖は種類ごとに細胞内で異なる機能を有していると考えられています。このようにユビキチン鎖ごとに機能が異なるのは、デコーダー分子がユビキチン鎖の種類を見分けているためです。私たちはデコーダー分子がどのようにユビキチン鎖を見分けているのかを原子レベルで理解することを目的に、デコーダー分子とユビキチン鎖との複合体の構造解析に取り組んでいます。
2. ユビキチン創薬に向けた構造解析
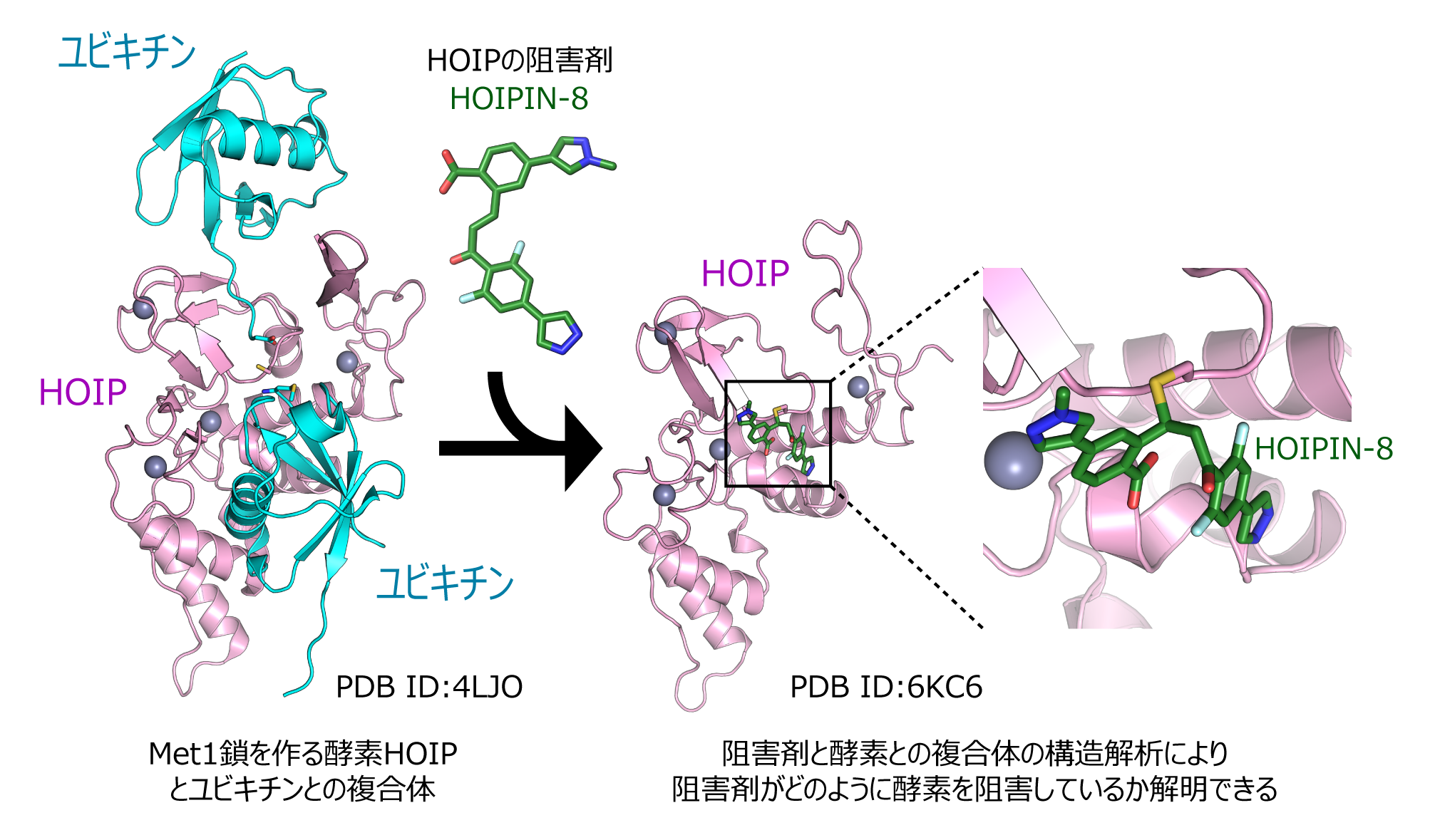 私たちは他大学との共同研究で、新規に開発された酵素阻害剤とユビキチン関連酵素との複合体の構造解析にも取り組んでいます。ユビキチン鎖は細胞内で、E1、E2、E3という三種類の酵素が順番に働くことで伸長しますが、その役割を終えると脱ユビキチン化酵素(DUB)によって切断されます。このユビキチン鎖の伸長反応と、切断反応のバランスが崩れると様々な疾病の原因となるため、ユビキチン連結酵素E3や脱ユビキチン化酵素の阻害剤は薬剤として働くと期待されています。酵素阻害剤と酵素との複合体の構造情報によって、阻害剤がどのようなメカニズムで機能しているのか、今後どのように阻害剤の形を変化させる事で効果の上昇が期待できるのか、といった事が解明できます。優れた阻害剤の開発は、将来的に疾病の作用機序の解明や創薬開発に貢献すると期待されます。
私たちは他大学との共同研究で、新規に開発された酵素阻害剤とユビキチン関連酵素との複合体の構造解析にも取り組んでいます。ユビキチン鎖は細胞内で、E1、E2、E3という三種類の酵素が順番に働くことで伸長しますが、その役割を終えると脱ユビキチン化酵素(DUB)によって切断されます。このユビキチン鎖の伸長反応と、切断反応のバランスが崩れると様々な疾病の原因となるため、ユビキチン連結酵素E3や脱ユビキチン化酵素の阻害剤は薬剤として働くと期待されています。酵素阻害剤と酵素との複合体の構造情報によって、阻害剤がどのようなメカニズムで機能しているのか、今後どのように阻害剤の形を変化させる事で効果の上昇が期待できるのか、といった事が解明できます。優れた阻害剤の開発は、将来的に疾病の作用機序の解明や創薬開発に貢献すると期待されます。
3. 様々な補因子によるp97/Cdc48制御機構の解明
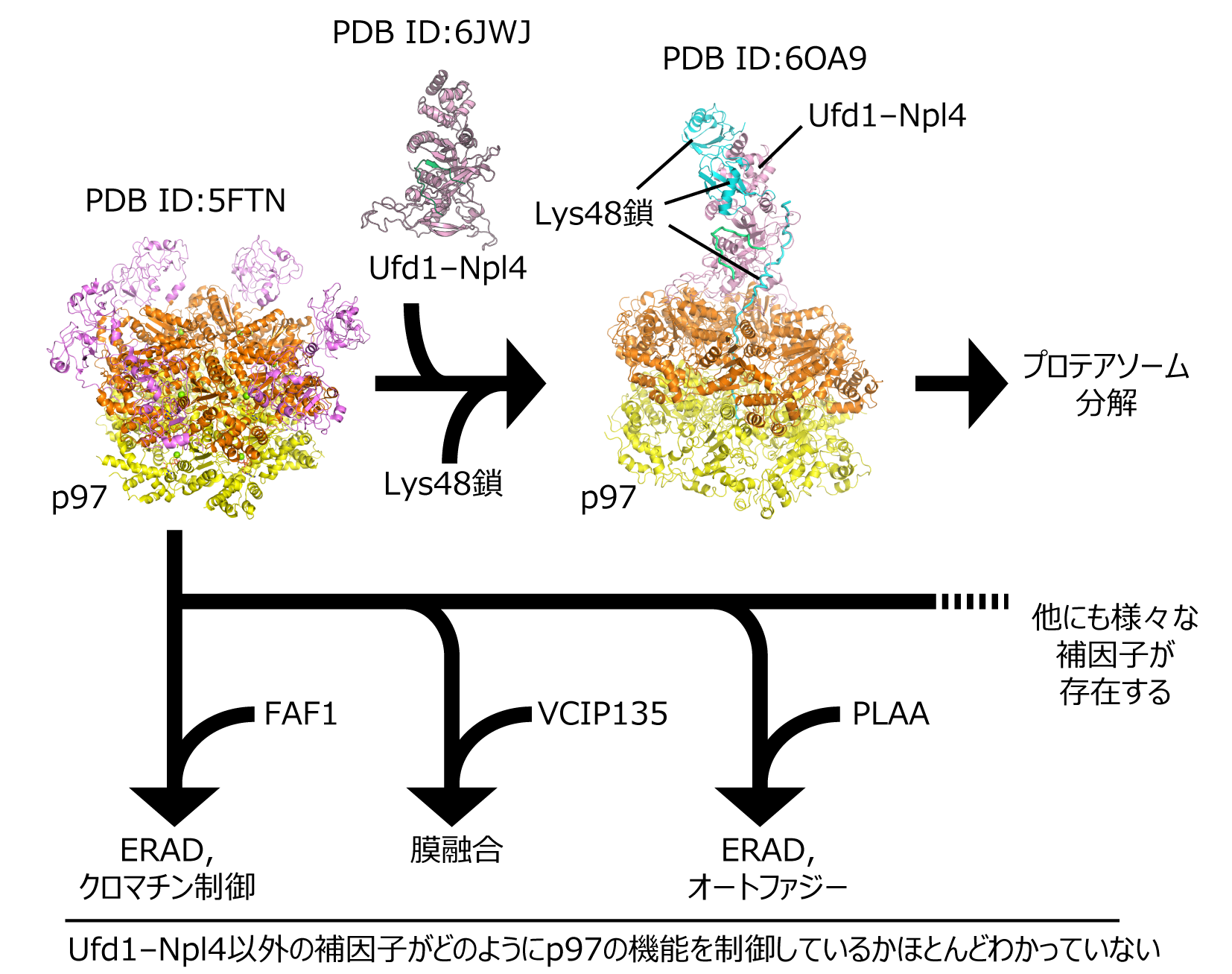 p97(酵母ではCdc48と呼ばれています)は6量体のリング状構造を持つタンパク質で、リングの孔からタンパク質を取り込み、ふらふらとした構造へと解きほぐす機能を持ちます。p97は約20種類存在する補因子を使い分けて働く事が知られていて、p97自体はユビキチンと直接相互作用しませんが、p97の補因子の多くはユビキチンとも結合するため、ユビキチン鎖が付加されたタンパク質を解きほぐすと考えられています。p97はこれらの補因子とともに様々な細胞機能を制御するため注目されていますが、一番よく解析されている補因子Ufd1とNpl4を除き、どのように補因子とともに働くのかという事はほとんどわかっていません。私たちは、Ufd1とNpl4以外の補因子がどのようにp97を制御しているのか明らかにすることを目的に、クライオ電子顕微鏡を用いた立体構造解析を目指しています。
p97(酵母ではCdc48と呼ばれています)は6量体のリング状構造を持つタンパク質で、リングの孔からタンパク質を取り込み、ふらふらとした構造へと解きほぐす機能を持ちます。p97は約20種類存在する補因子を使い分けて働く事が知られていて、p97自体はユビキチンと直接相互作用しませんが、p97の補因子の多くはユビキチンとも結合するため、ユビキチン鎖が付加されたタンパク質を解きほぐすと考えられています。p97はこれらの補因子とともに様々な細胞機能を制御するため注目されていますが、一番よく解析されている補因子Ufd1とNpl4を除き、どのように補因子とともに働くのかという事はほとんどわかっていません。私たちは、Ufd1とNpl4以外の補因子がどのようにp97を制御しているのか明らかにすることを目的に、クライオ電子顕微鏡を用いた立体構造解析を目指しています。